八隅體規則(或稱八電子規則)是化學中一個規則,即原子間組合趨向令各原子價層擁有惰性氣體電子排列。
主族元素,如碳、氮、氧、鹵素族、鈉、鎂依這個規則。
而言,組成離子或分子原子電子層有八個電子,它們會趨向,而若8個時,原子間會共享或交換電子達到。
1916年,吉爾伯特·路易斯其「立方原子理論」制定八隅體規則時使用了阿貝格規則。


[1]
第一層電子有2個,第二層8個,第三層18個,第四層32個。
公式2n2。
19世紀末,有科學家發現配合物是原子或分子組成,令其組成原子原子價滿足某條件。
1893年阿爾弗雷德·維爾納發現,與中央連接原子或官能基數目(「配位數」)是4或者6,可以是8,不過發生。
1904年,理查德·阿貝格提出阿貝格規則,指出元素化合價正值和負值相差8。
1916年,吉爾伯特·路易斯其「立方原子理論」制定八隅體規則時使用了阿貝格規則。
八隅體規則(或稱八電子規則)是化學中一個規則,即原子間組合趨向令各原子價層擁有惰性氣體電子排列。
主族元素,如碳、氮、氧、鹵素族、鈉、鎂依這個規則。
而言,組成離子或分子原子電子層有八個電子,它們會趨向,而若8個時,原子間會共享或交換電子達到。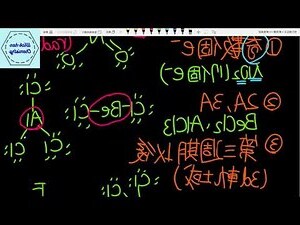
例如ClNa形成NaCl結構。
[1]
第一層電子有2個,第二層8個,第三層18個,第四層32個。
主族元素,如碳、氮、氧、鹵素族、鈉、鎂依這個規則。
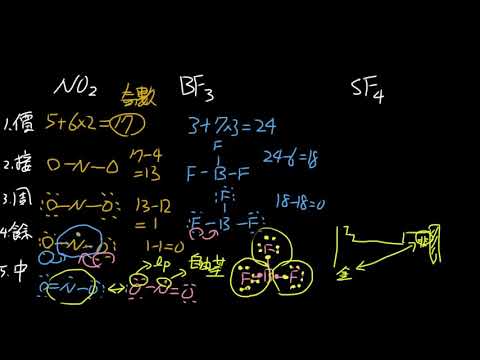

延伸閱讀…
19世紀末,有科學家發現配合物是原子或分子組成,令其組成原子原子價滿足某條件。
1893年阿爾弗雷德·維爾納發現,與中央連接原子或官能基數目(「配位數」)是4或者6,可以是8,不過發生。
1904年,理查德·阿貝格提出阿貝格規則,指出元素化合價正值和負值相差8。
1916年,吉爾伯特·路易斯其「立方原子理論」制定八隅體規則時使用了阿貝格規則。
八隅體規則(或稱八電子規則)是化學中一個規則,即原子間組合趨向令各原子價層擁有惰性氣體電子排列。
主族元素,如碳、氮、氧、鹵素族、鈉、鎂依這個規則。
延伸閱讀…
而言,組成離子或分子原子電子層有八個電子,它們會趨向,而若8個時,原子間會共享或交換電子達到。
例如ClNa形成NaCl結構。
[1]八隅體法是美國化學家路易斯(G. N. Lewis)所提出。
他觀察到第18(8A)族元素具有ns2np6(n ≥ 2)電子組態(氦1s2),單原子氣體存在,與其他原子形成化合物,呈一電子組態。
因此原子傾向藉由失去、得到或共用電子,以使其原子達到價殼層有八個電子電子組態,稱為八隅體法。
例如氟分子(F2)是共用電子對以達到八隅體電子組態,如下圖所示。
但有不符合八隅體法物質,如PCl5、BF3、NO。
