共價鍵的類型
在配位共價鍵的形成過程中,電子施予者提供一對電子,而電子接受者則提供一個空軌域。路易士鹼和路易士酸的相互作用產生的配位共價鍵,其性質與一般的極性共價鍵相同。然而,配位共價鍵的形成需要兩個條件:電子接受者必須具有能接受電子對的空軌域,而電子施予者則必須具有欲鍵結原子上能夠提供孤對電子的原子。
金屬離子可以接受多於一對電子,通常會形成配位數為 2、4 或 6 的錯合物。配位數是指一個錯合物中與金屬離子相連的配位子的數量,而金屬離子配位數的大小會受到金屬離子相對大小以及配位子大小的影響。


混成軌域
混成理論是一種化學概念,用於描述原子間鍵結的性質。它將多個原子軌域混合形成新的稱為混成軌域的軌域,可以用來解釋分子的分子軌域形狀和分子的形狀。
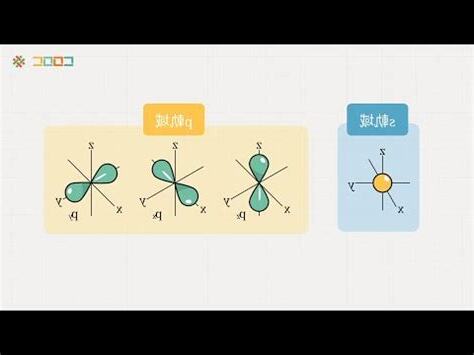
混成軌域的形成涉及原子的激發,當一個低能級軌域的電子被激發到高能級軌域時,便會產生新的混成軌域。例如,碳原子在形成甲烷時,一個 2s 軌域電子會被激發到 2p 軌域,然後 2s 軌域與三個 2p 軌域進行混成,形成四個等價的 sp3 混成軌域。這些 sp3 混成軌域可以與氫原子的 1s 軌域重疊,形成四個 σ 鍵,使甲烷分子形成正四面體形狀。
混成軌域的類型取決於參與混成的原子軌域的數量和類型。常見的混成軌域類型包括:
- sp 混成:由一個 s 軌域和一個 p 軌域混成形成,具有線形形狀。
- sp2 混成:由一個 s 軌域和兩個 p 軌域混成形成,具有平面三角形形狀。
- sp3 混成:由一個 s 軌域和三個 p 軌域混成形成,具有正四面體形狀。
VSEPR 理論
價層電子對互斥理論 (VSEPR) 是一個化學理論,用於預測分子的形狀。該理論認為,一個分子中的價電子對會相互排斥,並盡可能遠離彼此。因此,分子的形狀將根據價電子對的數量和排列方式而定。
VSEPR 理論與混成理論相輔相成,共同用於解釋分子的結構和形狀。舉例來説,一個 AX3E 型式的分子(其中 A 代表中心原子,X 代表配位子,E 代表孤對電子)會形成三角錐形,因為三個成鍵電子對和一對孤對電子需要相互排斥,以最大程度地減少相互排斥。
二氧化氮的特殊情況
二氧化氮 (NO2) 是 AX2E 型式的分子,按照 VSEPR 理論,其應當為彎曲形。然而,實驗表明,NO2 分子實際上是角形。這種例外現象可以通過混成理論來解釋。
在 NO2 分子中,氮原子以 sp2 混成,具有兩個等價的 sp2 混成軌域和一個 p 軌域。兩個 sp2 混成軌域與兩個氧原子形成 σ 鍵,而 p 軌域則包含未成鍵電子。由於 p 軌域的形狀,未成鍵電子會分佈在兩個相鄰的區域,從而形成角形形狀。
空軌域判斷:理解化合物性質的關鍵
空軌域判斷在化學中扮演著至關重要的角色,它能幫助我們預測和理解化合物的性質。空軌域是指分子中未被電子佔據的原子軌域,它決定了分子的反應性、穩定性以及與其他分子的相互作用。
空軌域判定的方法
空軌域的判斷主要有以下方法:
| 方法 | 説明 |
|---|---|
| 分子軌域理論 | 通過建立分子軌域圖,可以確定分子的空軌域 |
| 價層電子對排斥理論 (VSEPR) | 根據價層電子對的排斥,可以預測分子的形狀和空軌域的方向 |
| 分子自旋量子數 | 分子的自旋量子數決定了分子的電子佔據狀態,從而可以推斷出空軌域 |
空軌域判斷的應用
空軌域判斷在化學中的應用非常廣泛,包括:
| 應用 | 説明 |
|---|---|
| 預測反應性 | 空軌域的能量和對稱性決定了分子與其他分子之間的反應能力 |
| 確定穩定性 | 分子的空軌域能量與穩定性密切相關,空軌域能量較低的分子更穩定 |
| 理解相互作用 | 空軌域的重疊決定了分子間的相互作用,例如氫鍵、範德華力等 |
| 設計分子 | 通過控制空軌域的性質,可以設計出具有特定性質的分子,例如催化劑、藥物等 |
空軌域判斷的實例
例如,甲烷(CH₄)中,碳原子 دارای一個空 2p 軌域。這個空軌域能與其他分子的價電子對相互作用,使甲烷具有較高的反應性。
相反,六氟化硫(SF₆)中,硫原子周圍有六個氟原子,形成一個八面體形狀。所有 3d 軌域都被價電子對佔據,因此沒有空軌域。這使得六氟化硫非常穩定和惰性。
總結
空軌域判斷是化學中一個重要的概念,它能幫助我們預測和理解化合物的性質。通過使用不同的方法,我們可以確定分子的空軌域,從而瞭解其反應性、穩定性和分子間相互作用。空軌域判斷在化學研究和分子設計中具有廣泛的應用。
延伸閲讀…
混成軌域種類判斷練習 – YouTube
配位鍵- 維基百科,自由的百科全書
