配位化合物(英語:coordination complex)稱配位錯合物、錯合物、錯鹽,是一個中心原子或離子加上周圍配置幾個結合分子或離子組成化合物;前者(中心)稱為配位中心(英語:coordination center),是金屬;後者(周圍)稱配體(英語:ligand)或絡合劑(英語:complexing agent)[1][2][3]。
配位中心配體配位鍵結合而形成複雜分子或離子構成一個單元,稱為「配位單元」;而任何含有配位單元化合物,稱為配位化合物[4]。
研究配合物化學分支稱為配位化學。
許多含金屬化合物,是含有過渡金屬(屬於元素週期表d區元素,例如鈦)化合物,是配位化合物[5]。
配合物是化合物中一個子類,應用於日常生活、工業生產及生命科學中,近些年來發展迅速。
它不僅無機化合物、有機金屬化合物相關聯,並且現今化學前沿原子簇化學、配位催化及分子生物學有重疊。
其中一個典型例子便是蔡氏鹽—K[Pt(C2H4)Cl3]。

人們開始接觸配位化合物,當時大多用作日常生活用途,原料基本上是天然取得,比如殺菌劑膽礬和用作染料普魯士藍。
對配合物研究開始於1798年。
法國化學家塔薩厄爾首次二價鈷鹽、氯化銨與氨水製備出CoCl3.6NH3,並發現鉻、鎳、銅、鉑金屬以及Cl−、H2O、CN−、CO和C2H4可以生成類化合物。
當時並無法解釋這些化合物成鍵及性質,進行大部分實驗侷限於配合物顏色差異觀察、水溶液可銀離子沉澱摩爾數以及電導測定。
於這些配合物中成鍵情況,當時盛行説法借用了有機化學思想,認為這類分子鏈狀,只有末端鹵離子可以離解出來,而銀離子沉澱。
然而這種説法牽,不能説事很多。
1893年,瑞士化學家維爾納總結了前人理論,首次提出了現代配位鍵、配位數和配位化合物結構一系列基本概念,解釋了很多配合物電導性質、異構現象及磁性。
自此,配位化學才有了本質上發展。
維爾納稱為「配位化學父」,並因此獲得了1913年諾貝爾化學獎。
1923年,英國化學家西季威克提出「原子序數」法則(EAN),提示了中心原子電子數它配位數之間關係。
很多配合物,是羰基配合物,是符合該法則,但有很多不符合例子。
雖然這個法則只是部分反映了配合物形成實質,但其思想推動了配位化學發展。
現代配位化學拘泥於電子施受關係,而是程度上藉助於分子軌道理論發展,開始研究類型配合物如夾心配合物和簇合物。
其中一個典型例子便是蔡氏鹽—K[Pt(C2H4)Cl3]。
雖然該化合物早在1827年製得,但直到1950年才研究其中反饋π鍵性質。
配位化合物構型配位數所決定,化合物中心原子周圍配位原子個數。
配位數金屬離子和半徑、電荷數和電子構型有關,2-9之間,鑭系元素和錒系元素配合物中常會出現10以上配位數。
圍繞中心原子配位原子看作點,以線連接各點,得到配位多面體。
配位數配合物構型關系列下表:[7]
五配位中,涉及到三角雙錐和四方錐兩種構型互變,因此,一部分五配位化合物結構是介於這兩個結構之間一種中間結構。
六配位化合物八面體外,有可能是三角稜柱結構,例如單核配合物[Re(S2C2Ph2)3]即屬於這一類。
七配位中,配合物可能是單帽八面體或單帽三角稜柱體結構。
配位數化合物中,八配位可以是四方反稜柱體、十二面體、立方體、雙帽三角稜柱體或六角雙錐結構;九配位可以是三帽三角稜柱體或帽四方反稜柱體結構;十配位可以是雙帽四方反稜柱體或雙帽十二面體結構;十一配位化合物很少,可能是單帽五角稜柱體或帽五角反稜柱體;十二配位如[Ce(NO3)6]3−,為理想二十面體;十四配位雙帽六角反稜柱體。
配位數,如最近研究PbHe152+,該離子中鉛配位數15。
[8]
以上只是配合物構型理想情況。
實際中配合物結構會發生畸變,原因可能是位阻效應、電子效應(參見姜-泰勒效應)或配體種類緣故。
異構現象是配合物具有重要性質之一。
配合物光學異構體為四面體型,中心原子四個基團,分子不能與鏡像重合。


延伸閱讀…
配合物異構現象包括立體異構和結構異構。
立體異構是化學式和原子排列次序,僅原子空間排列異構現象。
立體異構主要分為幾何異構和光學異構。
幾何異構是組成配合物配體空間幾何排列而致異構現象,主要出現配位數4平面正方形和配位數6八面體結構中,順式-反式異構體面式-經式異構體形式存在。
空間關係上考慮,順式(cis-)是指配體處於鄰位,反式(trans-)是指配體處於對位。
八面體[MA3B3]兩種異構體中,面式(fac-)或順-順式指3個A和3個B各佔八面體三角面頂點,經式(mer-)或順-反式是指3個A和3個B八面體外接球子午線上並列。
見下圖:
稱雙齒平面正方形配合物[M(AB)2]有可能有幾何異構現象,結構類似於上面鉑,見下圖:
多核配合物有幾何異構現象。
例如,Pt(II)雙核配合物[Pt2(PPr3)2(SEt)2Cl2]順反異構體製得,且室温下其苯溶液是。
但反式或苯溶液中加入痕量三丙基膦作催化劑能完全轉變順式。
[7]
光學異構是立體異構另一種形式,兩種光學異構體會使平面偏振光發生等量但方向偏轉,因此稱旋光異構或對映異構。
大多數配合物溶液中都會失去旋光性,這一過程稱為消旋作用。
情況,消旋機理可能是分子間或分子內。
配合物光學異構體為四面體型,中心原子四個基團,分子不能與鏡像重合。
延伸閱讀…
例如[BeII(C6H5COCHCOCH3)2]。
而於八面體構型配合物而言,光學異構主要發生以下幾種情況下:
結構異構是化學式,但原子排列次序異構體,主要可分為以下幾類:
配位化合物化學鍵理論,主要研究中心原子配體之間結合力本性,用以説配合物物理及化學性質,如磁性、穩定性、反應性、配位數幾何構型。
配合物理論起始於靜電理論。
而後西季威克鮑林提出配位共價模型,應用配合物中價鍵理論,統治了這一領域二十餘年,可以地解釋配位數、幾何構型、磁性一些性質,但配合物顏色和光譜無能力。
價鍵理論認為,配體提供電子進入了中心離子空原子軌道,使得配體中心離子共享這兩個電子。
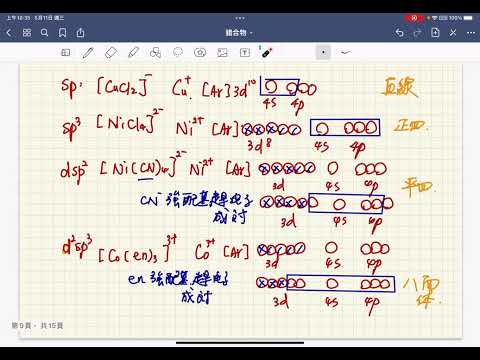
配位鍵形成經歷了三個過程:(激發)、雜化和成鍵,其中雜化稱軌道雜化,是能量相近原子軌道線性組合成數量且能量簡併雜化軌道過程。
由此可衍生出外軌/內軌型配合物概念,從而通過判斷配合物電子構型及雜化類型,可以得出配合物磁性、氧化原反應性質以及幾何構型。
於很多經典配合物來説,價鍵理論得出結果是貼近事實。
價鍵理論之外,而後發展晶體場理論配位場理論是配合物理論。
晶體場理論看作點電荷,並配位鍵作離子鍵處理,可看作是靜電理論延伸。
並且,它幾何構型中,配體空間取向d軌道作用作為切入點,得出取向d軌道會發生能級分裂,並建立起分裂能及晶體場化能概念,推測配合物電子組態及定性。
晶體場理論可以地解釋配合物顏色、熱力學性質和配合物畸變現象,但不能合理解釋光譜化學序列,不能地應用於/價配合物、夾心配合物、羰基配合物和烯烴配合物。
配位場理論結合了分子軌道理論晶體場理論。
它理論上,然而定量計算則難,計算過程中引進處理,因而只能得到結果。
配合物結構是指其原子分子或錯合物中,配位基原子配體幾何型態。
配位基幾何型態排列會因配位數目及其與中心原子鍵結之型式而改變。
金屬中心氧化狀態會改變其配位傾向。
金屬中心所配位配位基數目可二個十五個多。
覺得這份筆記有用話,要不要追蹤作者呢?這樣能收到筆記通知喔!獲得學習協助,包括考試準備、入學考試準備以及課堂預習、複習摘要筆記。
