鹽結晶原理是一種自然現象,當鹽水溶液中的水分逐漸蒸發,鹽會慢慢聚集並形成晶體。這個過程涉及到凝結、沉澱和晶體生長的規律。鹽結晶原理不僅在自然界中觀察到,也是許多化學工藝和食品加工的重要基礎。例如,在食鹽的生產中,鹽結晶原理被用來控制和促進鹽的分離和沉澱,從而提高食鹽的純度。同時,對鹽結晶原理的研究,還有助於我們理解如何在不同的環境條件下,控制和改進鹽結晶的過程,以適應不同的應用需求。
港台這些地區的居民,往往習慣在室內放置一盆鹽,用來除濕、除臭或抗氧化。這種方法的原理,其實是基於鹽類晶體的濃度一這樣每一個環境中,總存在著一定的鹽溶液平衡濃度。當鹽溶液蒸發時,鹽分會逐漸沉澱在地板上、天花板和黑暗角落等不易進入空氣的地方。這樣一來,空氣中的水蒸氣含量減少,室內的相對濕度也就降低了。
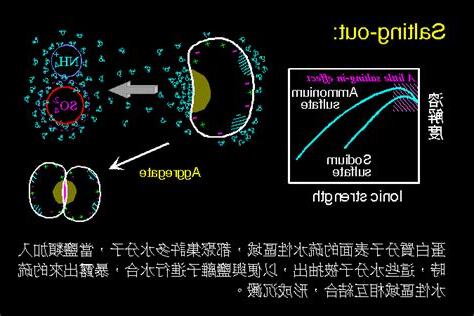
鹽析結晶是從含有電解質的溶液中,加入某種鹽析劑,這種新加入的鹽,它的離子與水結合的能力比原來溶液中的其它鹽類更強,因此減少了溶液中自由水的數量,從而增加了欲結晶物質的有效濃度,最終使得欲結晶物質在溶液中析出結晶。研究顯示,水對陰離子和陽離子都有較強的溶劑化作用,但對陽離子的作用尤為顯著。因此,鹽析劑的主要作用是通過陽離子與水的相互作用來實現的。鹽析劑與水的結合越緊密,其鹽析效應就越明顯。水的溶劑化能力與離子的大小有關,離子越小,水的溶劑化數就越大,鹽析效應也越強。選擇鹽析劑時,通常會選擇陽離子半徑較小、電荷較多的化學物質,例如鉀離子、鋁離子、鐵離子、鎂離子等,這些物質形成的氯化物或硝酸鹽常常用於化工生產中的鹽析過程。為了找到最合適的鹽析劑,我們通過實驗探索,最終確定了一種效果較佳的鹽析劑。




選擇合適的鹽析劑
- 鹽析劑的選擇基於其離子與水的結合能力,以及離子的大小和電荷數。
- 陽離子半徑小、電荷數高的鹽類通常具有較強的鹽析效應。
- 探索性實驗用於評估不同鹽析劑的效果,並確定最佳鹽析劑。