酸度係數(英語:Acid dissociation constant,又名酸解離常數,代號Ka、pKa、pKa值),化學及生物化學中,是指一個常數,代表一種酸解離氫離子能力。
離解化學反應(酸電離反應通式)為:
狀況會氫離子來表達,反映出酸質子理論:
於酸這個常數會有所不同,所以酸度係數會常用對數加法逆元,符號pKa,來表示:
同一濃度下,Ka值(或pKa值)離解能力,代表酸。


水濃度[H2O]是會係數中顯示。
一種酸pKa酸性,pKa酸性(反過來説,Ka值,解離度,酸性,Ka值,部份解離,酸性)。
pKa<0酸水中是,介於04.0之間中,其他為弱酸。
離解化學反應(酸電離反應通式)為:
狀況會氫離子來表達,反映出酸質子理論:
於酸這個常數會有所不同,所以酸度係數會常用對數加法逆元,符號pKa,來表示:
同一濃度下,Ka值(或pKa值)離解能力,代表酸。
來説,Ka>1(或pKa<0),強酸;Ka<10-4(或pKa>4),弱酸。
利用酸度係數,可以計算酸濃度、共軛鹼、質子及氫氧離子。
如一種酸是部份中和,Ka值可以來計算出緩衝溶液pH值。
其中Kw25℃下為1.0 × 10-14,pKw14。


延伸閱讀…
由此類,可以共軛鹼A–定義鹼度係數Kb及pKb:
同樣,Kb值代表鹼,這是同一濃度下可以接收質子。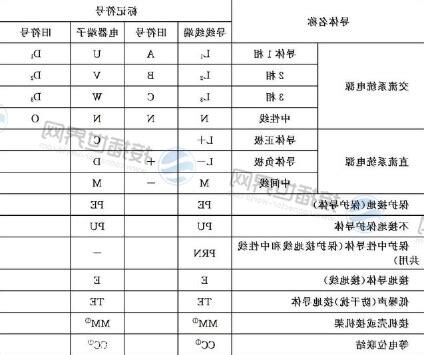
於HAA–電離作用等同於水自我離子化,酸度係數鹼度係數積相等於水離解常數(Kw),故pKapKb和即為pKw。
其中Kw25℃下為1.0 × 10-14,pKw14。
延伸閱讀…
於KaKb積是數,酸即代表共軛鹼;酸,則代表共軛鹼。
作為一個常數,酸度係數Ka是反應物化合物,應是質子化狀態(AH)脱質子化狀態(A–)能差ΔG°來計算。
分子相互作用偏向脱質子化狀態時會提升Ka值([A–]與[AH]比增加),或是降低pKa值。
相反,分子作用偏向質子化狀態時,Ka值會下降,或提升pKa值。
